由来自宾夕法尼亚大学Abramson癌症中心的一个多学科研究人员小组领导的一项新研究表明,利用三重威胁包括放疗以及靶向CTLA4和PD-1信号通路的两种免疫疗法来治疗转移性黑色素瘤,可以在更多的患者中引起最佳的反应,增强免疫系统对疾病的攻击。研究结果发表在今日的《自然》(Nature)杂志上。
资深作者、放射肿瘤学助理教授Andy J. Minn博士、癌症研究教授Robert Vonderheide博士,放射肿瘤学教授Amit Maity博士,以及宾夕法尼亚大学Perelman医学院免疫研究所主任和微生物学教授E. John Wherry博士共同领导了这项研究。这是研究人员第一次报道放疗结合抗CTLA4抗体ipilimumab在人类患者和小鼠中的反应及治疗耐受情况。
在一项称作为“RadVax”试验的I期临床研究中,研究小组发现ipilimumab结合放疗是安全的, 22名转移性黑色素瘤患者中18%的人肿瘤缩小。同时开展的小鼠研究阐明了在许多癌症发展患者中的一种治疗耐受机制:PD-L1信号通路,表明一种对抗PD-L1或伴侣蛋白PD-1的抗体是提高治疗反应和免疫的理想第三疗法。
Minn说:“这些新型免疫疗法作为有效的治疗方案,在过去几年里生成了很多令人兴奋的结果,但我们也知道许多患者对它们不产生反应,表明有必要进一步地提高这些药物性能。有趣的是,我们知道结合放疗和免疫疗法可以取得很好的疗效,因此我们有极大的动力通过临床实验向前进一步证实这种组合治疗是一条有前景的、值得追寻的道路,并通过实验室研究来了解反应发生及不发生背后的原因。”
Ipilimumab是获得FDA批准的一种抗CTLA4抗体,它可以用来松开对免疫系统的刹车,使得T细胞能够浸润并攻击肿瘤细胞。癌细胞利用PD-L1信号通路来躲避免疫系统,近来一些抗PD-1疗法即阻断PD-L1信号通路的抗体包括pembrolizumab或nivolumab也获得了FDA的批准。
人们相信,增加辐射可导致协同攻击,将遭到破坏的肿瘤细胞转变为一种对抗癌症的疫苗。人们认为,受到辐射的肿瘤细胞会释放出一些抗原,帮助训练免疫系统对抗机体内其他的肿瘤。由于它的疫苗样特性,这种治疗被称作为“RadVax”。
开展这项I临床研究的动力来自由共同作者、宾夕法尼亚大学Abramson癌症中心血液学/肿瘤学主任Lynn M. Schuchter博士用抗CTLA4抗体治疗的一名50来岁的转移性黑色素瘤患者。当给予抗CTLA4抗体时,患者的病情发生了恶化,他要求接受了姑息性放射治疗。在接受两种治疗后的几个月里,并且在未做进一步治疗的情况下,他的转移性癌症开始消退,最终被认定为几乎无癌。
试图借鉴他的治疗经历,研究人员招募了22名从前接受治疗及未接受治疗的IV期黑色素瘤患者来展开I期临床实验调查了两种疗法的效用。这组患者在接受了对单个肿瘤的体部立体定向放射治疗(Stereotactic Body Radiation Therapy,SBRT)3-5天后,分4个疗程每三周给予一次ipilimumab治疗。
研究小组发现,18%的患者未经辐射的肿瘤获得了部分缓解,18%的患者疾病稳定,64%的患者疾病发生了进展。在平均18.4和21.3个月的随访期内患者的中位无进展生存期和总生存期分别为3.8个月和10.7个月。这组患者的总生存率为35%。而过去的一项III期研究显示仅接受ipilimumab治疗患者的总生存率为20%。
Maity说:“这种方法改变了我们对于辐射的认识——从一种局部的疗法转变为了当给予免疫疗法时可以增强全身反应的治疗方法。”
在小鼠中研究人员也获得了相似的结果:17%的小鼠对放疗和抗CTLA4抗体组合治疗产生反应。
为了更好地了解在许多患者中看到的治疗耐受背后的机制,研究人员转而借助了小鼠。作者们说,在放疗和抗CTLA4治疗后复发的小鼠肿瘤揭示出,已知抑制T细胞激活的PD-L1在最高度上调的基因之中构成了一个“抗性基因标记”。事实上,肿瘤显示高水平PD-L1的小鼠T细胞丧失功能,所有的均治疗无效。
在小鼠中,抑制PD-L1可恢复T细胞的功能,以及肿瘤对放疗及抗CTLA4治疗的反应,将生存率提高到了60%。回到临床试验中,那些肿瘤显示高水平PD-L1的患者T细胞也丧失了功能,所有的均治疗失败,而肿瘤显示低水平PD-L1的患者有50%的生存率。作者们由此断定,肿瘤细胞上的PD-L1是对放疗和ipilimumab的一个主要的耐受机制。
Minn说:“了解治疗耐受机制非常的重要。尽管当组合更多的疗法时可以改善结果,但副作用风险也随之增加。精准施药要求了解何时给予更多治疗以及给予什么治疗。”
Vonderheide说:“这些结果非常令人鼓舞,将使得我们能够进一步地推动研究工作,进入更大型的临床研究来调查这一三重威胁疗法”。
来源: 生物通 作者:何嫱
为你推荐
 资讯
资讯 圣因生物完成超 1.1 亿美元 B 轮融资,加速 RNAi 疗法全球布局
本轮融资由知名产业机构领投,国际主权基金、中国生物制药、君联资本等十余家机构跟投,全球制药巨头礼来公司战略入局,高瓴创投、启明创投等现有股东持续加码支持,融资规模创...
2025-12-12 16:59
 资讯
资讯 投后估值达21.37亿元,实体瘤细胞治疗领军企业君赛生物递表港交所
君赛生物共有5款在研产品,其中核心产品也是进展最快的是GC101,正开展上市前的关键II期临床试验,有望成为国内首个获批上市的TIL细胞创新药
2025-12-12 09:24
 资讯
资讯 ESMO-IO | ORR达41.7%!君赛生物GC101 TIL治疗晚期后线非小细胞肺癌I期数据首次公布
这不仅是全球首个无需高强度清淋化疗、无需IL-2给药的TIL疗法治疗肺癌的临床研究,也是国内首个公开披露该领域数据的注册性临床研究。
2025-12-12 09:17
 资讯
资讯 君合盟生物启动重组 A 型肉毒毒素治疗成人上肢痉挛状态临床 III 期试验,并完成首例患者入组
该临床试验由复旦大学附属华山医院李放教授和上海市养志康复医院(即上海市阳光康复中心)靳令经教授联合牵头
2025-12-11 21:06
 资讯
资讯 Medidata发布全新调研报告:临床试验AI应用价值凸显,超七成用户反馈“达到或超预期”
基于对来自全球制药公司、生物科技公司及合同研究组织(CRO)中超200位核心决策者的深度调研,报告显示,目前AI在改善患者招募、优化数据管理、控制运营成本和提升试验效率等方...
2025-12-11 20:57
 资讯
资讯 近20年首个全新类别抗菌药物醋酸来法莫林纳入医保,开启中国成人社区获得性肺炎治疗普惠新篇章
该产品继2025年6月30日获得国家药品监督管理局批准用于治疗成人社区获得性肺炎(CAP)后又纳入国家医保目录
2025-12-11 20:50
 资讯
资讯 专注 “生物学 + AI” ,普瑞基准完成超亿元 D 轮融资,加速 AI 驱动新药研发
本轮融资由信立泰、广投资本、申宏中恒基金联合领投,老股东金谷汇枫、聚翊投资持续跟投
2025-12-10 15:55
 资讯
资讯 别把“嗜睡”当懒癌!新型促觉醒药翼朗清®获批,专注维持日间清醒
促觉醒药物翼朗清®(盐酸索安非托片)正式获得中国国家药品监督管理局(NMPA)批准,用于改善阻塞性睡眠呼吸暂停(OSA)伴有日间过度嗜睡(EDS)的成人患者的觉醒程度。
2025-12-10 11:04
 资讯
资讯 复星医药将其GLP-1产品全球化权益授权辉瑞,总里程碑付款近150亿人民币
12月9日晚间,复星医药发布公告称,公司控股子公司药友制药、复星医药产业与辉瑞共同签订《许可协议》,(其中主要包括)由药友制药就口服小分子胰高血糖素样肽-1受体(GLP-1R)...
2025-12-10 09:12
 资讯
资讯 Capricor Therapeutics公司宣布外泌体疗法Deramiocel在DMD三期中取得积极成果
近日,专注与外泌体疗法的Capricor Therapeutics(纳斯达克代码:CAPR)公司宣布其核心管线Deramiocel在杜氏肌营养不良症关键三期 HOPE-3 研究中取得积极成果。
2025-12-09 16:38
 资讯
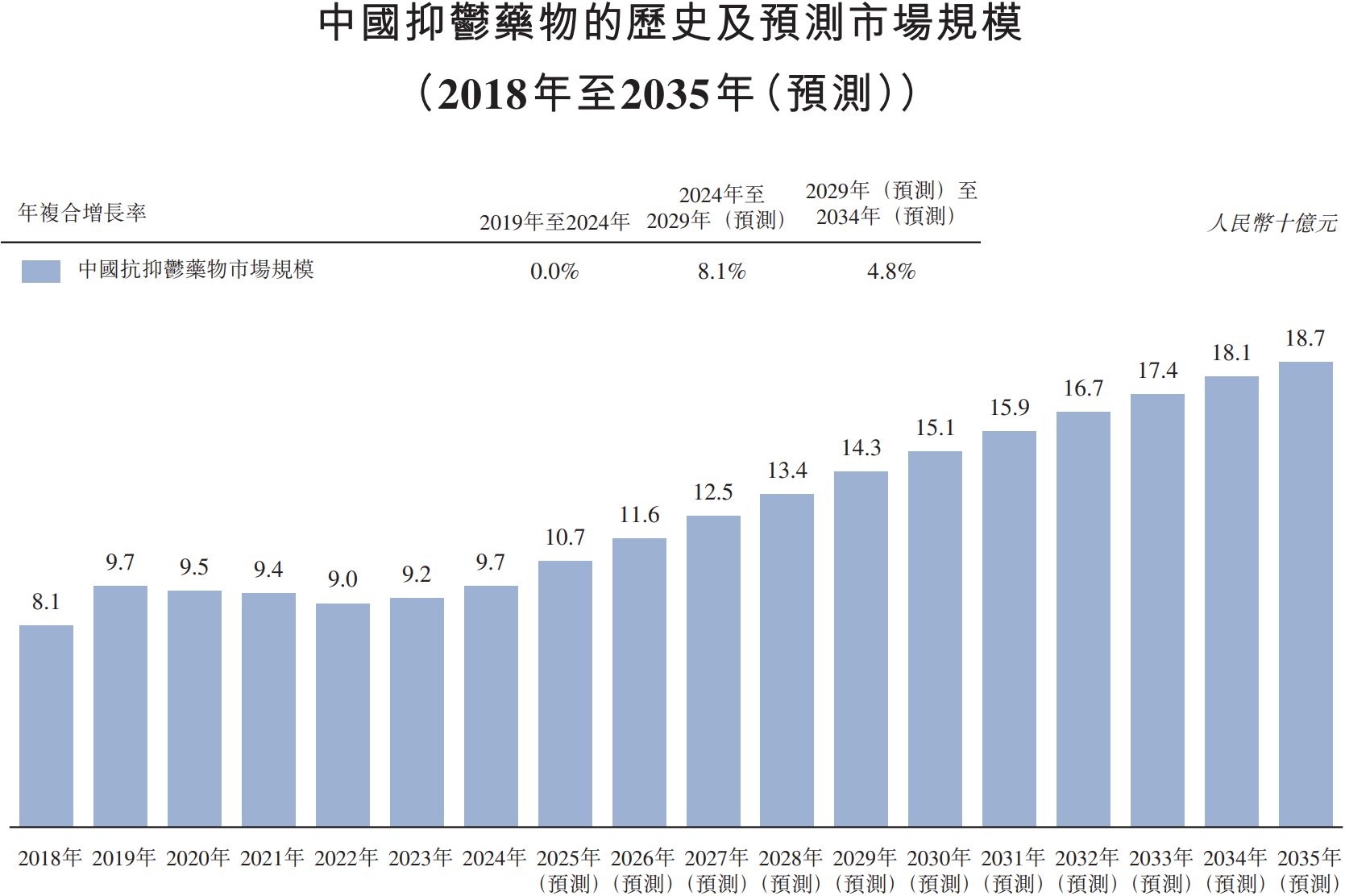
资讯 中药1类创新药剑指抑郁症治疗蓝海,远大医药GPN01360成功达到国内II期临床终点
国产抗抑郁症药物研发取得重大进展。近日,远大医药(0512 HK)的1 1类中药创新药GPN01360国内II期临床研究成功达到临床终点,产品表现出显
2025-12-08 18:27