在对21名乳腺癌患者的基因组的研究发现,多数乳腺癌患者在被确诊之前,体内的癌变就已经开始。在临床上,只有癌变发展到一定程度,癌变才有可能被目前的诊断手段所发现。而事实上,癌症的发生过程应以体细胞变异为起点,如此算来,患者早在十余年前就已经患上癌症。
现在对癌症的早期发现仍然是非常困难的事情。科学家正在努力攻克早期检测癌症的难题。科学家们相信,“在未来的十年里,癌症死亡数可以被降低75%,但是只有在我们把更大的力量投入到早期诊断和预防上时,这个数字才有可能达到。”
走出广州医学院第一附属医院的大门时,28岁的陈小川一脸茫然。她怎么也想不通,与她同龄的丈夫不抽烟、不喝酒、每周坚持游泳,为什么会突然被查出肺癌晚期?一份来自国内最权威的呼吸病研究机构的“判决书”,让这个家庭毫无准备地走上了艰辛的抗癌之路。
与陈小川夫妇相似,对于绝大多数的肿瘤患者来说,癌症都是来得那么突然。为什么有些人抽了一辈子烟也没有得肺癌,为什么有些女人到了50岁以后乳腺癌的发病率高达80%?导致临床上1/7死亡病例的癌症似乎无处不在,又无据可查。
然而来自英国桑格研究院(Wellcome Trust Sanger Institute)的最新研究表明,癌细胞在癌症发生的过程中留下了蛛丝马迹。“这些痕迹就像是留在癌细胞DNA中的考古学印记,癌细胞中的突变过程在癌症引起注意之前很多年,就已经被激活了。”
斯特拉顿(Mike Stratton)教授领导的研究小组,通过测序分析21个乳腺癌患者基因组,发现了癌症发生发展过程中出现的突变,首次解析了癌症发生发展的全过程。基于这一研究成果的两篇重磅论文接连发表在《细胞》杂志上。
1 癌症进化树
“所有的癌症都是由突变引起的,这些突变称为体细胞突变,是在人一生当中,由最初正常细胞中的DNA逐渐出现的。”斯特拉顿教授说。
基因发生突变的体细胞,在与正常体细胞生存竞争的过程中不断进化,最终变成永生不死的癌细胞。癌细胞无限制地增殖,进而导致肿瘤的发生。这听起来很像是达尔 文关于物种起源的“进化论”。两者的区别在于,物种的进化要历经成千上万年,而癌变的发生,则只需要数年,甚至更短的时间。
在癌变发生的过程中,体细胞的每一次突变,都会在其基因组上留下印迹。就像是在一次次地加盖印戳。分析基因组上不同时期体细胞变异时留下的印迹,就可以得到癌细胞完整的进化史。
“我们就像考古一样挖掘出了这项癌症基因组,揭示了之前未知的突变模式。虽然我们并不确切了解引发这些突变模式的生物学机理,但是我们认为正常细胞中产生突变 的某些过程被过度激活了,这样简单的引发了过多突变的出现,造成癌症。”斯特拉顿教授就是根据这个原理,通过研究21名乳腺癌患者的基因组,绘制出乳腺癌 体细胞突变的进化树。
据此阐释了癌变发生的详细过程:最初基因突变的体细胞首先会不断分化,形成一个庞大的突变体细胞家族。家族的成员经过体内微环境的“自然选择”,只有生存能 力最强的亚克隆才能不断增殖。同时,通过这种方式,癌症基因在突变体细胞内不断累积,后者也逐渐完成了自身的进化。但某一突变体细胞的亚克隆占到其家族细 胞总数的半数以上,患者就会临床上表现出癌症的具体症状。
“英国学者的这项最新研究犹如为癌症的发生发展构建了一棵进化树。”国内乳腺癌专家、中山大学附属第二医院副院长宋尔卫教授在接受笔者采访时对此评价,这项研究的成果与肿瘤发展的分支演化理论相符合。
“同一个树干,好比物种起源时的同一个祖先,在进化过程中由于受到环境的影响,分出不同分叉的物种,向不同的方向发展,肿瘤细胞也类似如此。”
“一些概率比较高的突变基因发生在肿瘤的早期,在肿瘤发展的过程中不断有新的突变出现,每一种新的突变衍生出一种新的分支,由树干到树枝,越来越细,树枝就代 表概率低的突变,也就是在肿瘤后期晚期发生出来的基因突变。”宋尔卫说,这项研究成果就像一棵进化树一样,描绘出一幅癌症基因组全景图。
2 细胞机制缺陷
癌变发生的过程表明,多数乳腺癌患者在被确诊之前,体内的癌变就已经开始。在临床上,只有癌变发展到一定程度,或者说,只有突变体细胞完成自身的进化,癌变 才有可能被目前的诊断手段所发现。而事实上,癌症的发生过程应以体细胞变异为起点,如此算来,患者早在十余年前就已经患上癌症。
“这 种现象很早就有人提出,癌细胞逃避人体免疫的监控后,在目前的技术还不能发现之前,被称为亚临床肿瘤。”宋尔卫说,“一个人一生中是否容易患癌症,可能在 出生的时候已经被肿瘤易感基因决定了,我们希望尽量把临床发现点提前到越早越好,但目前还无法提前到肿瘤刚发生的时候。”
斯特拉顿教授在论文中阐述,“我们不认为这些突变模式是外部因素,比如吸烟,或者光照引起的,这些常被认为是引发突变和癌症的因素,相反我们认为引发这些突变模式的是内部细胞机制缺陷。”
“但为什么有些即使存在突变,人体内的免疫系统也会把这些早期癌细胞清除掉,而有些突变即使不是很明显,但是还是能够引起许多癌症基因的激活?”
宋尔卫教授认为,基因突变的确很大程度上取决于先天缺陷,但是这些缺陷的基因能不能表达,或者是这个基因在突变之后会不会扩增,将受到很多因素的影响,比如 转录水平、转录前水平和转录后水平的调控,这些被称为表观遗传调控的因素不依赖于DNA序列。“这些调控现在被认为比DNA序列的突变更重要,受环境的影 响更大。”
“英国学者的研究目前从DNA序列层面上提供了肿瘤异质性的依据,但肿瘤的发生发展更重要取决于基因表达谱的变化,有突变的基因不一定表达,或者有些没有突变的基因可能有过表达,另外还涉及蛋白质有没有表达,蛋白质表达有没有信号通路激活等等。”宋尔卫说。
对此,斯特拉顿教授在论文中也表示,目前还需要更多的实验,来验证细胞机制缺陷引发突变的观点。
英国的研究者还发现了一种独特的体细胞突变机制——“kataegis”模式。
在基因组一个小范围的区域内,短时间内会发生大量的基因突变。这与体细胞突变中通常“循序渐进”的方式大相径庭,这种突变的频率与密度,犹如“疾风骤雨”一般,因此,该模式以“kataegis”(希腊语“暴风雨”的意思)来命名。
虽然,此突变机制在以前的研究中从未被发现。但是,在被研究的 21名乳腺癌患者体内,至少有13人体内发生了“kataegis”突变。这预示着此种突变方式可能在癌症患者体内广泛存在。进一步的研究发 现,“kataegis”突变模式的发生,可能与细胞中的一种蛋白家族有关。
3 体细胞突变
尽管体细胞突变会导致机体发生癌变,但是在癌变过程中,不同的体细胞突变所发挥的作用却不尽相同。
早在2009年,斯特拉顿教授就在《自然》杂志上发表文章,提出了“司机突变—乘客突变”学说。他将癌变的细胞比作高速公路上飞驰的汽车。能够直接导致癌变 的体细胞突变称之为“司机突变”(Driver Mutation);而与癌症发生相关,但不是起主导作用的突变,则被称为“乘客突变”(Passenger Mutation)。这就好比:车祸发生了,责任在于肇事的司机,而不是同车的乘客。
近年来,癌症基因组的研究发现,癌变过程中与之相关的体细胞突变位点有成千上万处。但这其中起决定性作用的司机突变往往不足十处。在恶性胶质瘤、白血病、皮 肤癌等患者体内,通常五个左右的司机突变就可直接导致癌症的发生。司机突变的个数,远远小于乘客突变的数目。如何从上万处体细胞突变中找到真正的罪魁祸 首,并不容易。
斯特拉顿教授领导的研究小组,通过对一百名乳腺癌患者的基因组进行研究,经过逻辑算法分析后,在总计两万一千余处体细胞突变中找到了诱发癌变的关键突变九处。这也使得迄今为止,发现的乳腺癌司机突变累积达四十个。该研究成果发表在2012年5月的《自然》杂志上。
更为复杂的是,这四十种司机突变,在不同的患者体内出现不同组合。在这一百名乳腺癌患者中,仅有28名患者体内只有一种司机突变,多数患者体内存在多种不同的司机突变组合,个别患者体内的司机突变最高可达六处。
斯特拉顿教授指出,“从目前的研究结果看,乳腺癌患者体内中至少存在七十余种司机突变组合。假设每名癌症患者体内存在四种司机突变,那么,临床上出现三名患者的遗传背景完全相同的概率几乎为零”。
司机突变的随机组合,导致了乳腺癌治疗难度大为增加。
无论是癌细胞的生活史会经历细胞分化,存在多种突变体细胞亚克隆,还是患者体内存在不同的司机基因组合。癌症基因组的最新研究进展都表明了,癌症本身是一种多遗传性疾病。
但是,目前癌症的诊疗却往往会忽视这一点。临床上的治疗策略主要针对数目占优的突变体细胞。以治疗乳腺癌的单抗药物赫赛汀(Herceptin)为例,它的 作用靶点是癌细胞过度表达的HER2基因。倘若患者体内的癌细胞中,存在不含HER2基因亚克隆,即便赫赛汀使用之初有效,随着此种癌细胞进化、增殖,同 样会导致癌症恶化或复发。
这也就解释了,为什么相同的治疗方案,面对不同的患者会有不同的疗效。治愈的癌症患者又存在病情复发的可能。
4 癌症基因组
1986年,诺贝尔奖获得者杜尔贝克(R.Dulbecco)在《科学》上发表文章指出,“如果我们想更多地了解癌症,就必须深入研究细胞的基因组”。这被视为癌症研究的转折点。同时,这一论述也直接促成了“人类基因组计划”的启动。
本世纪初,人类基因组草图绘制完成。癌症的研究开始进入基因组学阶段。除了英国桑格研究院启动的“癌症基因组计划”,2005年美国癌症研究所和美国人类基 因组研究所共同启动“人类癌症基因图集”计划,旨在绘制500例癌症患者的基因图谱;2008年,国际癌症基因组联合会成立,包括中国在内的九个国家,共 同针对临床上的五十余种癌症进行基因组学研究。
在以上癌症基因组计划的推动下,近年来,诱发乳腺癌、皮肤癌、肺癌、脑瘤等癌症的关键基因不断被确认。这就从分子的层面,揭示癌变的发生机制。
正如斯特拉顿教授所言,“基因组学的研究,可以在细节上揭示癌症的发生过程,这为制定更为精确的诊疗手段奠定了基础。”
2012年3月,以我国华大基因研究院为主的科研团队,采用“单细胞外显子组测序技术”对血癌、肾癌进行基因组学研究。
华大基因的科学家团队分别对一名骨髓瘤患者体内的58个癌细胞和一名肾癌患者的25个癌细胞进行基因测序,发现了肿瘤组织内部不同癌细胞有着非常大的差异。同时,他们推断了肿瘤的复杂演化过程,并据此进一步明确了诱发癌变的一些重要突变。
在传统的癌症治疗实践中,通常将一些药物直接用于某类癌症病人中,然而这些发现预示着不同患者的癌症组织差别很大,因此在用药前需要对每个患者的癌症组织进行仔细分析,才能够“对症下药”,也就预示了癌症的个体化治疗的必要性与紧迫性。
就在英国桑格研究院关于乳腺癌基因组研究成果发布不久,美国圣犹大儿童医院-华盛顿大学儿童癌症基因组计划公布了迄今为止最大的人类癌症基因组全面数据。一部分数据公布在2012年5月29日出版的《自然遗传》上。
公布的数据包含520个基因组序列,研究人员分析了这些基因组数据,找出每个儿童正常和癌变细胞中的差别,从而了解最致命儿童癌症中超过一半以上的致病原 因。儿童癌症基因组计划希望能在2012年年底,完成1200个基因组序列的测定,这些数据将免费提供给全球的科学团队。
“这些数据离临床还很远,”宋尔卫教授认为,即使临床医生知道有这个基因突变表达,但是还没有相应的靶点药物。所以这些数据对科研的价值比目前对临床的价值更大。它是非常宝贵的科研数据,有很多厂家可以利用这些数据去设计抗癌药物。
但即使这些研究离临床治疗还有距离,但也是人类在征服癌症中的积累式进步。
正如二十多年前研究发现25%-30%的乳腺癌表达过HER2基因,如今针对这个基因的靶向药物赫赛汀已经上市,而且已经救了很多人的生命。
“一篇论文,不可能一下子就把肿瘤征服,但它确实是人类解决肿瘤问题的过程中一篇里程碑式的文章。我们需要不断地积累,才能最终解决肿瘤的问题。”宋尔卫说。
或许在未来的某一天,当全基因组测序已经成为普通人体检的一项常规项目,新生儿出生后必须通过测序建立个人基因档案,肿瘤发生发展的过程和节点早在意料之中,到那时预防癌症将不再是人类的终极梦想。
来源:南方周末
为你推荐
 资讯
资讯 圣因生物完成超 1.1 亿美元 B 轮融资,加速 RNAi 疗法全球布局
本轮融资由知名产业机构领投,国际主权基金、中国生物制药、君联资本等十余家机构跟投,全球制药巨头礼来公司战略入局,高瓴创投、启明创投等现有股东持续加码支持,融资规模创...
2025-12-12 16:59
 资讯
资讯 投后估值达21.37亿元,实体瘤细胞治疗领军企业君赛生物递表港交所
君赛生物共有5款在研产品,其中核心产品也是进展最快的是GC101,正开展上市前的关键II期临床试验,有望成为国内首个获批上市的TIL细胞创新药
2025-12-12 09:24
 资讯
资讯 ESMO-IO | ORR达41.7%!君赛生物GC101 TIL治疗晚期后线非小细胞肺癌I期数据首次公布
这不仅是全球首个无需高强度清淋化疗、无需IL-2给药的TIL疗法治疗肺癌的临床研究,也是国内首个公开披露该领域数据的注册性临床研究。
2025-12-12 09:17
 资讯
资讯 君合盟生物启动重组 A 型肉毒毒素治疗成人上肢痉挛状态临床 III 期试验,并完成首例患者入组
该临床试验由复旦大学附属华山医院李放教授和上海市养志康复医院(即上海市阳光康复中心)靳令经教授联合牵头
2025-12-11 21:06
 资讯
资讯 Medidata发布全新调研报告:临床试验AI应用价值凸显,超七成用户反馈“达到或超预期”
基于对来自全球制药公司、生物科技公司及合同研究组织(CRO)中超200位核心决策者的深度调研,报告显示,目前AI在改善患者招募、优化数据管理、控制运营成本和提升试验效率等方...
2025-12-11 20:57
 资讯
资讯 近20年首个全新类别抗菌药物醋酸来法莫林纳入医保,开启中国成人社区获得性肺炎治疗普惠新篇章
该产品继2025年6月30日获得国家药品监督管理局批准用于治疗成人社区获得性肺炎(CAP)后又纳入国家医保目录
2025-12-11 20:50
 资讯
资讯 专注 “生物学 + AI” ,普瑞基准完成超亿元 D 轮融资,加速 AI 驱动新药研发
本轮融资由信立泰、广投资本、申宏中恒基金联合领投,老股东金谷汇枫、聚翊投资持续跟投
2025-12-10 15:55
 资讯
资讯 别把“嗜睡”当懒癌!新型促觉醒药翼朗清®获批,专注维持日间清醒
促觉醒药物翼朗清®(盐酸索安非托片)正式获得中国国家药品监督管理局(NMPA)批准,用于改善阻塞性睡眠呼吸暂停(OSA)伴有日间过度嗜睡(EDS)的成人患者的觉醒程度。
2025-12-10 11:04
 资讯
资讯 复星医药将其GLP-1产品全球化权益授权辉瑞,总里程碑付款近150亿人民币
12月9日晚间,复星医药发布公告称,公司控股子公司药友制药、复星医药产业与辉瑞共同签订《许可协议》,(其中主要包括)由药友制药就口服小分子胰高血糖素样肽-1受体(GLP-1R)...
2025-12-10 09:12
 资讯
资讯 Capricor Therapeutics公司宣布外泌体疗法Deramiocel在DMD三期中取得积极成果
近日,专注与外泌体疗法的Capricor Therapeutics(纳斯达克代码:CAPR)公司宣布其核心管线Deramiocel在杜氏肌营养不良症关键三期 HOPE-3 研究中取得积极成果。
2025-12-09 16:38
 资讯
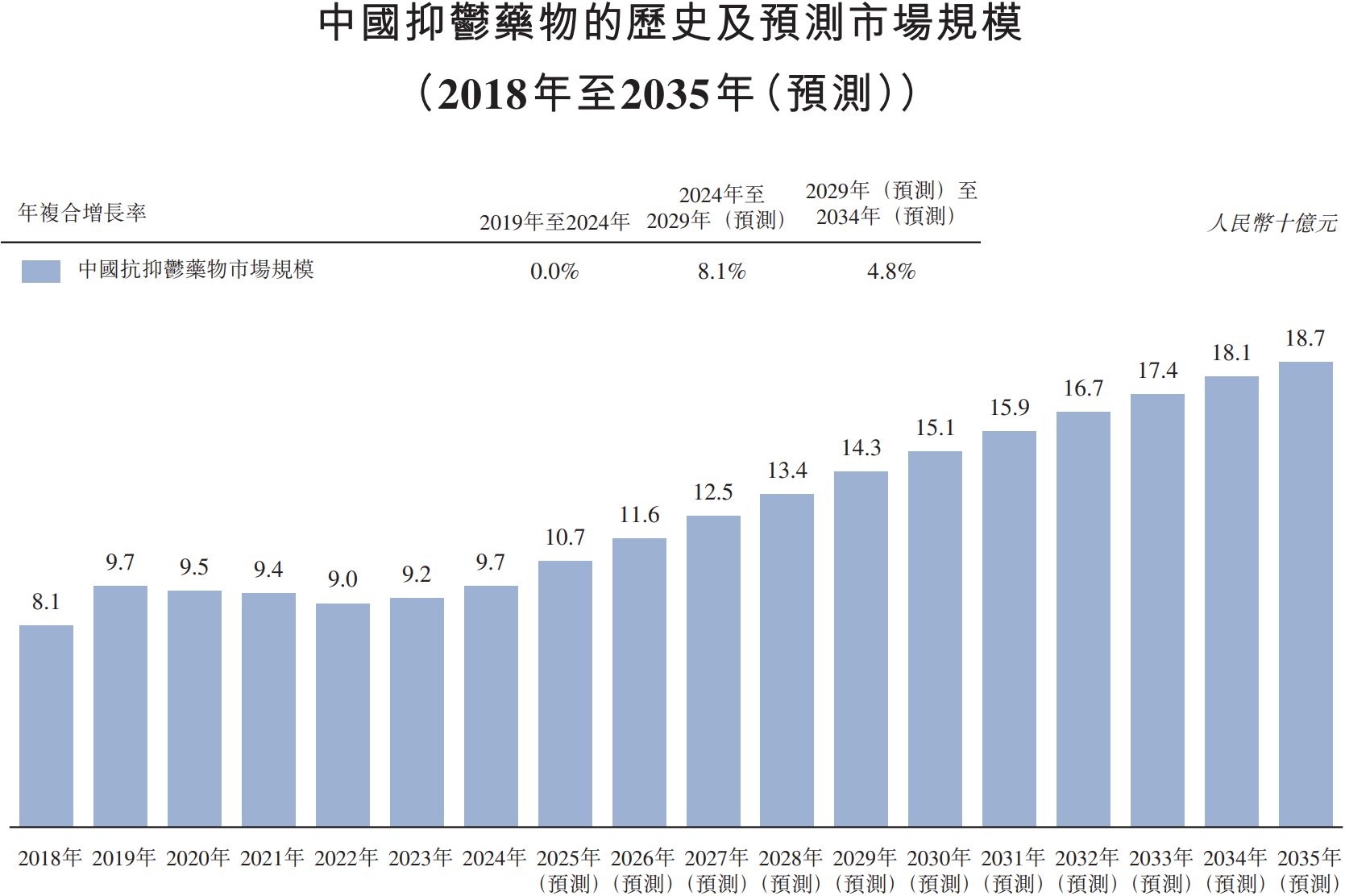
资讯 中药1类创新药剑指抑郁症治疗蓝海,远大医药GPN01360成功达到国内II期临床终点
国产抗抑郁症药物研发取得重大进展。近日,远大医药(0512 HK)的1 1类中药创新药GPN01360国内II期临床研究成功达到临床终点,产品表现出显
2025-12-08 18:27